Covid-19 : arrêt puis reprise de l'essai clinique du vaccin d'Oxford
LONDRES - Le monde entier attend et espère un vaccin contre le coronavirus (Covid-19). Les fabricants de seringues augmentent leurs productions mais de Londres est tombé mercredi 9 septembre 2020 une mauvaise nouvelle : l'arrêt de l'un des essais cliniques les plus avancés. Cela dit, 3 jours après l'étude clinique de ce vaccin a pu reprendre.
Le groupe pharmaceutique anglo-suédois AstraZeneca, partenaire industriel de la prestigieuse université britannique Oxford (c'est pourquoi on parle parfois de vaccin d'Oxford), a détecté un éventuel effet indésirable grave chez un participant aux essais cliniques de son vaccin expérimental.
Il s'agit de l'apparition d'une maladie non-expliquée chez un volontaire. "Dans le cadre des essais cliniques randomisés mondiaux du vaccin contre le coronavirus de l'université d'Oxford, notre processus d'évaluation normal a été déclenché et nous avons volontairement fait une pause dans les vaccinations pour permettre une évaluation de sécurité par un comité indépendant", a déclaré la société.
Selon le site spécialisé Statnews, les essais ont été interrompus en raison "d'une suspicion d'un effet indésirable grave chez un participant au Royaume-Uni".
Selon le New York Times, le problème a été détecté chez un volontaire du Royaume-Uni. Il a été diagnostiqué de myélite, un syndrome inflammatoire de la colonne vertébrale, très souvent provoqué par des infections virales.
 |
"Quelque chose de plus grave"
Pour David Lo, professeur à l'Université de California Riverside, "d'autres effets indésirables" ont déjà été signalés, "comme de la fièvre, des douleurs (..) donc cela pourrait être quelque chose de plus grave", a-t-il affirmé à l'AFP.
"Les essais sont souvent suspendus temporairement lorsqu'un effet indésirable se manifeste chez un patient, pour que les chercheurs puissent informer" les sites où des essais sont également menés, a-t-il souligné.
Cette pause dans les essais pourrait retarder l'un des projets occidentaux parmi les plus avancés, avec ceux des sociétés américaines Moderna et Pfizer, chacun étant en train de recruter des dizaines de milliers de volontaires afin de vérifier que les doses sont sûres, et empêchent les personnes vaccinées de tomber malades du Covid-19.
Les trois sociétés disaient jusqu'à présent espérer des résultats avant la fin de l'année ou le début de 2021, et ont commencé à fabriquer des millions de doses en avance au cas où ils seraient probants.
AstraZeneca a pré-vendu des centaines de millions de doses à de multiples pays dans le monde, plus qu'aucun de ses concurrents.
 |
L'UE prévoyante
Cette annonce, la première d'une telle nature parmi les dizaines d'essais cliniques en cours dans le monde, est intervenue quelques heures avant que l'Union européenne n'annonce avoir passé un autre accord préliminaire pour obtenir 200 millions de doses d'un potentiel vaccin développé par l'alliance germano-américaine Biontech/Pfizer.
L'UE a déjà conclu des accords pour s'assurer l'accès aux éventuels vaccins des groupes Sanofi-GSK, Johnson & Johnson, CureVac, Moderna et AstraZeneca. La Suisse a elle annoncé en août avoir conclu un accord avec l'entreprise américaine Moderna pour la livraison de 4,5 millions de doses d'un vaccin.
Milliards de seringues
En Russie, les autorités de Moscou ont annoncé avoir commencé à tester le vaccin russe sur 40'000 habitants de la capitale, dernière étape des essais de ce vaccin annoncé en grande pompe en août. La Russie a annoncé début août avoir développé le "premier" vaccin contre le Covid-19, baptisé Spoutnik V, mis au point par le centre de recherches Nikolaï-Gamaleïa.
Il a toutefois été accueilli avec scepticisme dans le monde, notamment à cause notamment de l'absence de phase finale des essais au moment de son annonce.
Le principal producteur de seringues indien, Hindustan Syringes, l'un des grands producteurs mondiaux de dispositifs d'injection, se prépare et augmente sa production. Il fabrique déjà chaque année 700 millions de seringues autobloquantes et table sur un milliard d'ici 2021.
Prashant Yadav, spécialiste de l'approvisionnement en matière de santé à la Harvard Medical School, assure à l'AFP que le monde devrait "avoir une capacité suffisante pour la première vague de vaccinations qui concernera des groupes prioritaires".
Mais "lorsque nous parviendrons à une vaccination à grande échelle à la fin 2021 ou en 2022 et que les estimations pour la demande de doses dépasseront les dix milliards, l'approvisionnement en seringues deviendra une contrainte", ajoute-t-il. L'Organisation mondiale de la santé (OMS) ne s'attend pas à une vaccination généralisée avant mi-2021.
Reprise
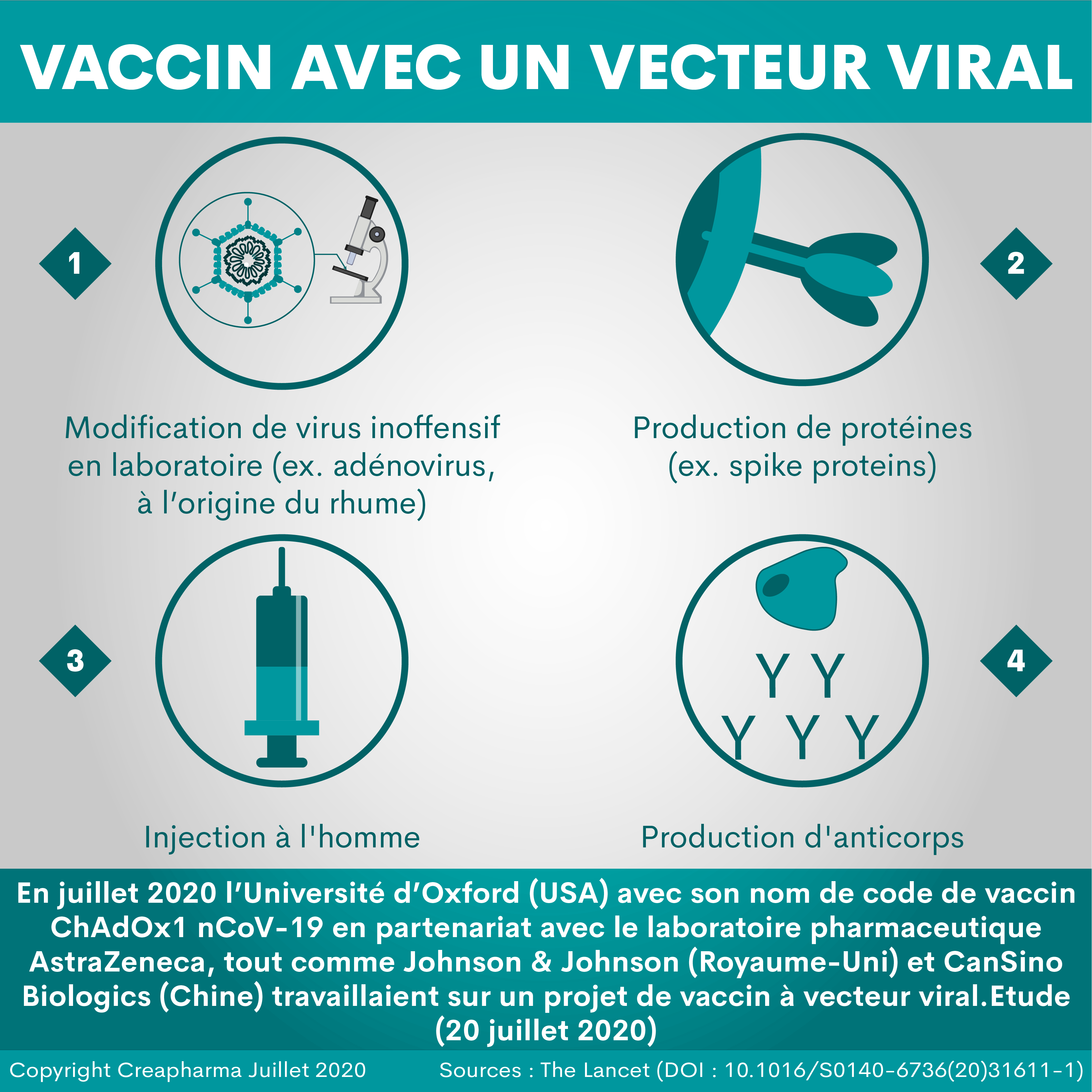
Le 12 septembre 2020, la société AstraZeneca a communiqué qu’elle reprenait son essai clinique de son vaccin contre la Covid-19 après le feu vert des autorités sanitaires. Un comité indépendant a jugé ce vaccin «sans danger». L’arrêt n’aura duré que 3 jours. En effet, le 9 septembre 2020 la société avait annoncé l’arrêt de l’un des essais cliniques les plus avancés, le projet de vaccin entre AstraZeneca et l’université britannique Oxford (d’où le nom de “vaccin d’Oxford”). Il s’agit d’un vaccin avec un vecteur viral (adenovirus modifié). La raison de cet arrêt de 3 jours provenait de la détection d’un éventuel effet indésirable grave provoqué par le vaccin chez un participant aux essais cliniques. Selon le New York Times, le problème a été détecté chez un volontaire du Royaume-Uni. Cette personne, une femme selon certaines sources, a été diagnostiquée de myélite, un syndrome inflammatoire de la colonne vertébrale, très souvent provoqué par des infections virales. Le vaccin d’Oxford repose sur deux injections pour atteindre l’immunité désirée.
Article mis à jour le 18 septembre 2020. Sources : Keystone-ATS, The New York Times, Folha de S.Paulo. Crédits photos: Adobe Stock, Pixabay ou Pharmanetis Sàrl (Creapharma.ch). Crédit infographie (si présente) : Pharmanetis Sàrl (Creapharma.ch).
